Tofacitinib citrat er et receptpligtigt lægemiddel (varenavn Xeljanz) oprindeligt udviklet af Pfizer til en klasse af orale Janus kinase (JAK) hæmmere. Det kan selektivt hæmme JAK-kinase, blokere JAK/STAT-veje og derved hæmme cellesignaltransduktion og relateret genekspression og aktivering, brugt til behandling af leddegigt, psoriasisgigt, colitis ulcerosa og andre immunsygdomme.
Lægemidlet omfatter tre doseringsformer: tabletter, tabletter med forlænget frigivelse og orale opløsninger. Dens tabletter blev første gang godkendt af FDA i 2012, og doseringsformen med forlænget frigivelse blev godkendt af FDA i februar 2016. Den er den første til at behandle leddegigt. Yan er en JAK-hæmmer indtaget oralt én gang dagligt. I december 2019 blev en ny indikation for medicin med forlænget frigivelse godkendt igen for moderat til svær aktiv colitis ulcerosa (UC). Derudover er de nuværende fase 3 kliniske forsøg med plaque psoriasis afsluttet, og yderligere seks fase 3 kliniske forsøg er i gang, som involverer aktiv psoriasisgigt, juvenil idiopatisk arthritis osv. Slags indikationer. Fordelene ved depottabletter, der er langtidsvirkende og kun skal tages én gang om dagen, er befordrende for håndtering og kontrol af patienters sygdomme.
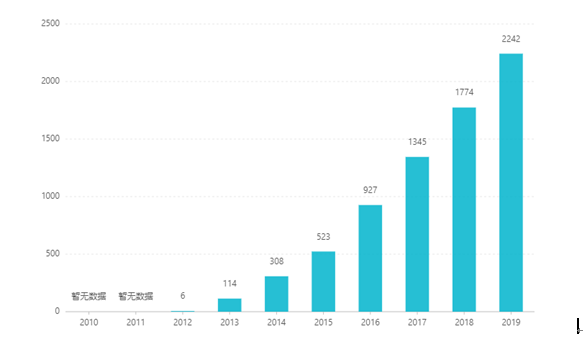
Siden dets børsnotering er dets salg steget år efter år og nåede op på 2,242 milliarder dollars i 2019. I Kina blev tabletdoseringsformen godkendt til markedsføring i marts 2017 og kom ind i sygeforsikringskategori B-kataloget gennem forhandlinger i 2019. Den seneste vindende bud er RMB 26,79. Men på grund af de høje tekniske barrierer for præparater med langvarig frigivelse er denne doseringsform endnu ikke blevet markedsført i Kina.
JAK kinase spiller en vigtig rolle i inflammation, og dets hæmmere har vist sig at behandle visse inflammatoriske og autoimmune sygdomme. Indtil nu er 7 JAK-hæmmere blevet godkendt globalt, herunder Leo Pharmas Delgocitinib, Celgenes Fedratinib, AbbVies upatinib, Astellas' Pefitinib, Eli Lillys Baritinib og Novartis's Rocotinib. Det er dog kun tofacitinib, baritinib og rocotinib, der er godkendt i Kina blandt de ovennævnte lægemidler. Vi ser frem til, at Qilus "Tofatib Citrate Sustained Release Tablets" bliver godkendt hurtigst muligt og til gavn for flere patienter.
I Kina blev det oprindelige forskningsprojekt tofacitibcitrat godkendt af NMPA i marts 2017 til behandling af voksne RA-patienter med utilstrækkelig effekt eller intolerance over for methotrexat under handelsnavnet Shangjie. Ifølge data fra Meinenet var salget af tofacitib-citrat-tabletter i Kinas offentlige medicinske institutioner i 2018 8,34 millioner yuan, hvilket var langt lavere end dets globale salg. En stor del af årsagen er prisen. Det er rapporteret, at Shangjie's oprindelige udsalgspris var 2085 yuan (5mg*28 tabletter), og den månedlige pris var 4170 yuan, hvilket ikke er en lille byrde for almindelige familier.
Det er dog værd at fejre, at tofacitib blev optaget på Sygesikringsstyrelsens ”Nationale Grundsygesikring, Arbejdsskadeforsikring og Barselsforsikrings Lægemiddelliste” 2019 efter forhandlinger i november 2019. Det oplyses, at det månedlige gebyr vil blive nedsat. til under 2.000 yuan efter prisnedsættelsen er forhandlet, hvilket i høj grad vil forbedre tilgængeligheden af lægemidlet.
I august 2018 traf Patent Reexamination Board of the State Intellectual Property Office en revisionsbeslutning nr. 36902 anmodning om ugyldighed og erklærede Pfizertofatibs kernepatent, det sammensatte patent, ugyldigt på grund af utilstrækkelig offentliggørelse af specifikationen. Imidlertid udløber patentet på Pfizertofatiib krystalform (ZL02823587.8, CN1325498C, ansøgningsdato 2002.11.25) i 2022.
Insight-databasen viser, at ud over den originale forskning er fem generiske lægemidler af Chia Tai Tianqing, Qilu, Kelun, Yangtze-floden og Nanjing Chia Tai Tianqing blevet godkendt til markedsføring i de indenlandske tofacitinib-tabletformuleringer. For tablettypen med forlænget frigivelse var det kun den oprindelige undersøgelse, som Pfizer indsendte en markedsføringsansøgning den 26. maj. Qilu er den første indenlandske virksomhed, der indsender en markedsføringsansøgning for denne formulering. Derudover er CSPC Ouyi i BE-prøvefasen.
Changzhou Pharmaceutical Factory (CPF) er en førende farmaceutisk producent af API'er, færdige formuleringer i Kina, som er beliggende i Changzhou, Jiangsu-provinsen. CPF er blevet grundlagt i 1949. Vi har dedikeret i Tofacitinib Citrate fra 2013, og indsendt DMF allerede. Vi har registreret os i mange lande og kan støtte dig med den bedste dokumentationsstøtte til Tofacitinib Citrate.
Indlægstid: 23-jul-2021